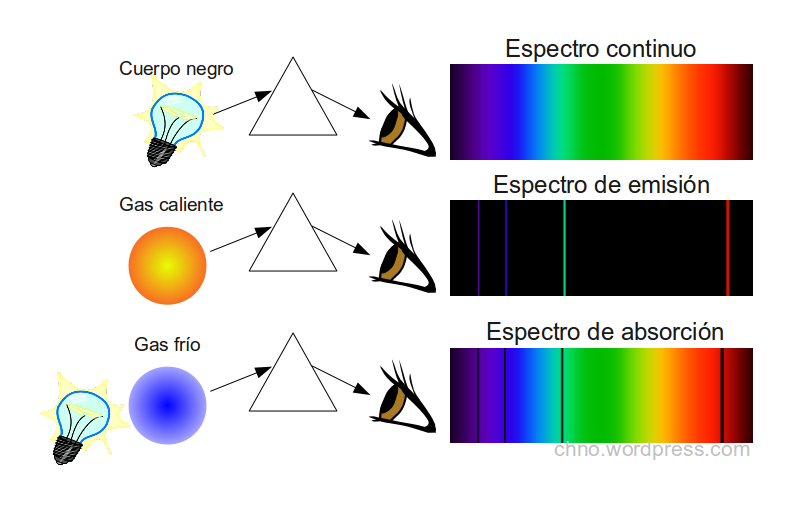
El espectro de emisión es una representación gráfica de la distribución de la intensidad de la radiación electromagnética emitida por una sustancia en función de la longitud de onda o la frecuencia de dicha radiación.
En el caso de los átomos, los espectros de emisión son discretos, es decir, consisten en líneas separadas que corresponden a longitudes de onda específicas. Cada línea corresponde a una transición entre dos estados energéticos diferentes del átomo.
Los espectros de emisión se pueden utilizar para identificar la composición de una sustancia, ya que cada elemento químico tiene un espectro de emisión característico.
¿Cómo se produce el espectro de emisión?
Los átomos pueden emitir radiación electromagnética cuando un electrón pasa de un estado de alta energía a un estado de menor energía. La energía emitida es igual a la diferencia de energía entre los dos estados.
La longitud de onda de la radiación emitida está determinada por la ecuación de Planck:
λ = h/E donde:
- λ es la longitud de onda de la radiación
- h es la constante de Planck
- E es la energía emitida
Por lo tanto, los espectros de emisión son discretos porque los estados energéticos de los átomos son discretos.
Tipos de espectros de emisión
Existen dos tipos principales de espectros de emisión:
- Espectros de emisión atómicos: Son producidos por átomos individuales.
- Espectros de emisión moleculares: Son producidos por moléculas.
Espectros de emisión atómicos
Los espectros de emisión atómicos se caracterizan por líneas estrechas y bien definidas. Las líneas corresponden a transiciones entre diferentes niveles de energía de los electrones de los átomos.
Los espectros de emisión atómicos se utilizan para identificar la composición de los elementos químicos. Por ejemplo, el espectro de emisión de hidrógeno consta de cuatro líneas estrechas que se encuentran en el rango visible del espectro electromagnético.
Espectros de emisión moleculares
Los espectros de emisión moleculares se caracterizan por bandas amplias y difusas. Las bandas corresponden a transiciones entre diferentes niveles de energía de los electrones de las moléculas.
Los espectros de emisión moleculares se utilizan para identificar la composición de las moléculas. Por ejemplo, el espectro de emisión de la molécula de oxígeno consta de una banda ancha en el rango infrarrojo del espectro electromagnético.
Aplicaciones de los espectros de emisión
Los espectros de emisión tienen una amplia gama de aplicaciones, entre las que se incluyen:
- Análisis químico: Los espectros de emisión se utilizan para identificar la composición de los elementos químicos y las moléculas.
- Astrofísica: Los espectros de emisión se utilizan para estudiar la composición de las estrellas y otros objetos celestes.
- Medicina: Los espectros de emisión se utilizan para diagnosticar enfermedades.
- Industria: Los espectros de emisión se utilizan para controlar la calidad de los productos.
Ejemplos de espectros de emisión
Espectro de emisión del hidrógeno
El espectro de emisión del hidrógeno es uno de los espectros de emisión atómicos más estudiados. Consta de cuatro líneas estrechas que se encuentran en el rango visible del espectro electromagnético.
Las líneas se conocen como líneas de Balmer y se corresponden con las siguientes transiciones de energía:
- Línea Hα: n = 3 → n = 2
- Línea Hβ: n = 4 → n = 2
- Línea Hγ: n = 5 → n = 2
- Línea Hδ: n = 6 → n = 2
Espectro de emisión del oxígeno
El espectro de emisión del oxígeno consta de una banda ancha en el rango infrarrojo del espectro electromagnético.
La banda se corresponde con las siguientes transiciones de energía:
- n = 3 → n = 1
- n = 4 → n = 1
- n = 5 → n = 1
- n = 6 → n = 1
Espectro de emisión de una llama
Cuando se introduce un elemento químico en una llama, los átomos del elemento se excitan y emiten radiación electromagnética. El espectro de emisión de la llama se utiliza para identificar la composición del elemento químico.
Por ejemplo, si se introduce sodio en una llama, se observará una línea amarilla brillante. Esta línea corresponde a la transición n = 2 → n = 1 de los átomos de sodio.
Conclusiones
Los espectros de emisión
Comenzaremos nuestra discusión al considerar la espectroscopía UV-Vis —es decir, lo que ocurre dentro de los átomos y las moléculas cuando fotones en el rango UV y visible del.Web Un espectro de emisión atómica es el patrón de líneas que se forman cuando la luz pasa a través de un prisma para separarlo en las diferentes frecuencias de.Web La siguiente imagen muestra el espectro de emisión del K (potasio): El conjunto de líneas espectrales que se obtiene para un elemento concreto es siempre el mismo, incluso si el.Web
Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales

Source: Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales
Espectro de emisión: qué es y cómo se produce – Curiosoando

Source: Curiosoando
Que Es Espectro De Emision Y Ejemplos, Que son los Espectros de emision y de absorcion, 5.47 MB, 03:59, 222,298, Quimica IES MIGUEL CATALAN de Coslada, 2018-10-07T20:41:10.000000Z, 1, Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales, Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales, 529 x 794, jpg, , 2, que-es-espectro-de-emision-y-ejemplos, KAMPION
Que Es Espectro De Emision Y Ejemplos. Los espectros de emisión de líneas están formados, como su nombre indica, por líneas luminosas que coinciden con una determinada longitud de onda. Las luces.Web
Explicación de los espectros de emisión y absorción
Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales
Que Es Espectro De Emision Y Ejemplos, La siguiente imagen muestra el espectro de emisión del K (potasio): El conjunto de líneas espectrales que se obtiene para un elemento concreto es siempre el mismo, incluso si el.Web
