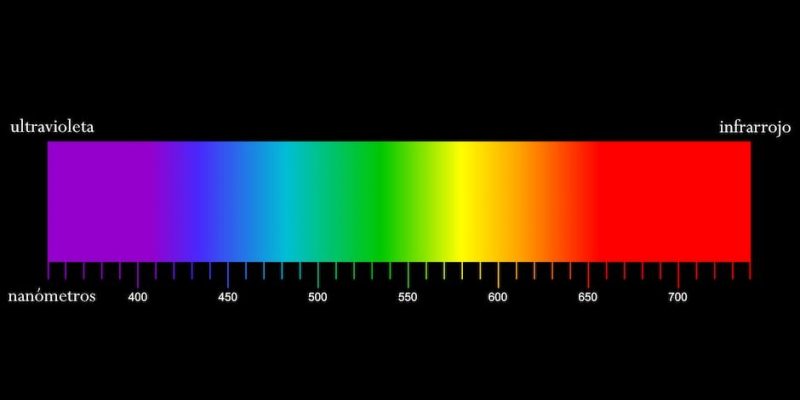
La luz es una forma de radiación electromagnética que se propaga en ondas. Tiene una amplia gama de longitudes de onda, desde los rayos gamma de longitud de onda muy corta hasta las ondas de radio de longitud de onda muy larga.
En química, los espectros de luz se utilizan para estudiar la estructura y composición de la materia. Pueden proporcionar información sobre la composición atómica o molecular de una sustancia, así como sobre su estructura electrónica, vibracional o rotacional.
Un espectro de luz es una representación gráfica de la intensidad de la luz, en función de su longitud de onda o frecuencia.
Los espectros de luz se pueden clasificar en dos tipos principales:
- Espectros de emisión: Son los espectros producidos por la emisión de luz por parte de átomos o moléculas.
- Espectros de absorción: Son los espectros producidos por la absorción de luz por parte de átomos o moléculas.
Espectros de emisión
Los espectros de emisión se producen cuando los átomos o moléculas pasan de un estado de energía más alto a un estado de energía más bajo. Al pasar de un estado de energía más alto a uno más bajo, los átomos o moléculas emiten energía en forma de luz.
Los espectros de emisión de los átomos son muy característicos de cada elemento químico. Esto se debe a que los átomos de cada elemento tienen una estructura electrónica única.
Por ejemplo, el espectro de emisión del hidrógeno consiste en una serie de líneas estrechas de colores que se denominan líneas de Balmer. Estas líneas se producen cuando los electrones del átomo de hidrógeno pasan de estados de energía más altos a estados de energía más bajos.
Los espectros de emisión de las moléculas son más complejos que los espectros de emisión de los átomos. Esto se debe a que las moléculas tienen una estructura electrónica más compleja que los átomos.
Los espectros de emisión de las moléculas se utilizan para estudiar la estructura molecular de las sustancias.
Espectros de absorción
Los espectros de absorción se producen cuando los átomos o moléculas absorben luz. Al absorber luz, los átomos o moléculas pasan de un estado de energía más bajo a un estado de energía más alto.
Los espectros de absorción de los átomos son muy característicos de cada elemento químico. Esto se debe a que los átomos de cada elemento tienen una estructura electrónica única.
Por ejemplo, el espectro de absorción del hidrógeno consiste en una serie de bandas oscuras de colores que se denominan bandas de Fraunhofer. Estas bandas se producen cuando los electrones del átomo de hidrógeno absorben luz y pasan de estados de energía más bajos a estados de energía más altos.
Los espectros de absorción de las moléculas son más complejos que los espectros de absorción de los átomos. Esto se debe a que las moléculas tienen una estructura electrónica más compleja que los átomos.
Los espectros de absorción de las moléculas se utilizan para estudiar la estructura molecular de las sustancias.
- espectro de luz
- espectro de emisión
- espectro de absorción
- átomo
- molécula
- longitud de onda
- frecuencia
- estructura electrónica
- vibración
- rotación
Conclusiones
Los espectros de luz son una herramienta importante en química. Se utilizan para estudiar la estructura y composición de la materia.
Los espectros de emisión y absorción proporcionan información diferente sobre la materia. Los espectros de emisión se utilizan para identificar elementos químicos y para estudiar la estructura electrónica de las moléculas. Los espectros de absorción se utilizan para identificar elementos químicos y para estudiar la estructura molecular de las moléculas.
Los espectros de luz tienen una amplia gama de aplicaciones en química. Se utilizan en la investigación, en la industria y en la educación.
WebLas frecuencias de luz que un átomo puede emitir depende de los estados en que los electrones pueden estar. Cuando están excitados, los electrones se mueven hacia una. Web1) Un sólido o un líquido luminoso emite un espectro continuo que contiene todas las longitudes de onda. No tiene líneas. 2) Un gas luminoso rarificado emite una luz que. WebIntroducción a la espectroscopía. Los químicos estudian cómo diferentes formas de radiación electromagnética interactúan con átomos y moléculas. Llamamos a esta. WebEn los siguientes apartados vamos a estudiar la manera en que la materia puede absorber energía y emitirla en forma de radiación electromagnética como la luz.. WebEn este video estudiamos la luz y el espectro electromagnético de radiación, el comportamiento onda-partícula y cómo calcular la longitud de onda o la frecuencia.
Espectro Visible – Qué es, longitud de onda y colores

Source: Concepto
La luz: ondas electromagnéticas, espectro electromagnético y fotones (artículo) | Khan Academy
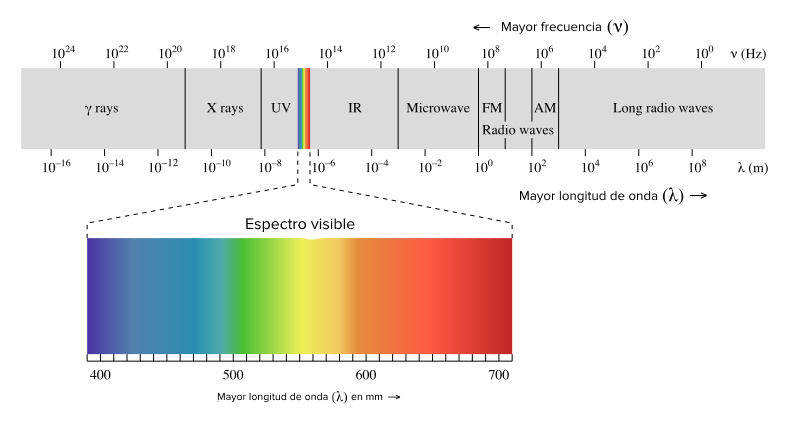
Source: Khan Academy
Que Es Un Espectro De Luz En Quimica, Que son los Espectros de emision y de absorcion, 5.47 MB, 03:59, 222,298, Quimica IES MIGUEL CATALAN de Coslada, 2018-10-07T20:41:10.000000Z, 1, Espectro Visible – Qué es, longitud de onda y colores, Concepto, 400 x 800, jpg, , 2, que-es-un-espectro-de-luz-en-quimica, KAMPION
Que Es Un Espectro De Luz En Quimica. WebDe estas interacciones, un químico puede obtener información sobre la estructura de una molécula, así como los tipos de enlaces que ocurren en ella. Antes de hablar de eso, sin embargo, es necesario hablar un poco de las propiedades físicas de las ondas de luz. WebEl espectro atómico de emisión es el espectro formado por la radiación emitida por los electrones en moléculas o átomos excitados; Un espectro de bandas es la parte de la.
Explicación de los espectros de emisión y absorción
Espectro Visible – Qué es, longitud de onda y colores
Que Es Un Espectro De Luz En Quimica, WebEn los siguientes apartados vamos a estudiar la manera en que la materia puede absorber energía y emitirla en forma de radiación electromagnética como la luz.. WebEn este video estudiamos la luz y el espectro electromagnético de radiación, el comportamiento onda-partícula y cómo calcular la longitud de onda o la frecuencia.
