En química, la diagonal es una regla que se utiliza para recordar el orden de energía de los orbitales atómicos. Esta regla es importante porque ayuda a los estudiantes a comprender cómo se distribuyen los electrones en los átomos.
Los orbitales atómicos son regiones de espacio alrededor del núcleo del átomo donde es probable encontrar un electrón. Los orbitales se clasifican según su nivel de energía, subnivel de energía y forma.
El nivel de energía de un orbital se indica por un número principal, n. Los orbitales con un número principal más alto tienen una energía más alta.
El subnivel de energía de un orbital se indica por una letra. Los subniveles de energía son s, p, d y f. Los orbitales s tienen la energía más baja, seguidos de los orbitales p, d y f.
La forma de un orbital se indica por una letra griega. Los orbitales s son esféricos, los orbitales p son de forma de duplo cono, los orbitales d son de forma de cuatro lóbulos y los orbitales f son de forma de ocho lóbulos.
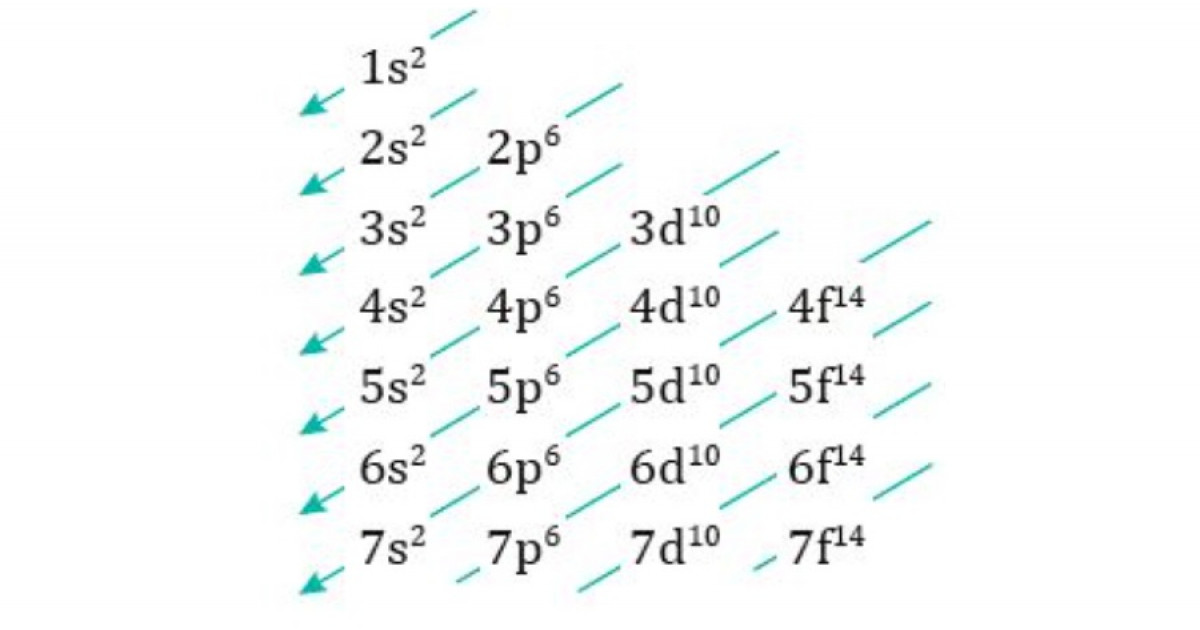
La regla de la diagonal establece que los orbitales con el mismo número de diagonales desde el orbital s más bajo tienen la misma energía.
Por ejemplo, los orbitales s, p y d en el nivel de energía n = 2 tienen la misma energía. Los orbitales s, p y d en el nivel de energía n = 3 también tienen la misma energía.
La siguiente tabla muestra los orbitales atómicos y su orden de energía según la regla de la diagonal:
| Nivel de energía | Subnivel de energía |
|---|---|
| 1 | s |
| 2 | s, p |
| 3 | s, p, d |
| 4 | s, p, d, f |
| 5 | s, p, d, f, g |
Por ejemplo, el átomo de sodio tiene un electrón en el orbital s del nivel de energía n = 1. El átomo de magnesio tiene dos electrones en el orbital s del nivel de energía n = 1 y un electrón en el orbital p del nivel de energía n = 1. El átomo de aluminio tiene tres electrones en el orbital s del nivel de energía n = 1, dos electrones en el orbital p del nivel de energía n = 1 y un electrón en el orbital s del nivel de energía n = 2.
La regla de la diagonal es una herramienta importante para los estudiantes de química. Esta regla ayuda a los estudiantes a comprender cómo se distribuyen los electrones en los átomos, lo que es esencial para comprender la química de los elementos y compuestos.
- Química
- Orbitales atómicos
- Nivel de energía
- Subnivel de energía
- Forma del orbital
- Regla de la diagonal
- Átomo de sodio
- Átomo de magnesio
- Átomo de aluminio
QUIMICA EPJA: REGLA DE LAS DIAGONALES Y CONFIGURACION ELECTRONICA
Source: QUIMICA EPJA
Diagrama de Moeller: qué es, cómo se usa en Química, y ejemplos
Source: Psicología y Mente
Cómo uso la Regla de las Diagonales ? En la tabla periódica entre los datos que encontramos de cada uno de los elementos, se hallan el Número atómico y. – ppt download

Source: SlidePlayer
Que Significa Diagonal En Quimica, 📒 Configuración Electrónica. Regla de las diagonales. Kernel, 7.9 MB, 05:45, 138,731, Lallett, 2021-03-13T21:55:32.000000Z, 2, QUIMICA EPJA: REGLA DE LAS DIAGONALES Y CONFIGURACION ELECTRONICA, QUIMICA EPJA, 720 x 960, jpg, , 3, que-significa-diagonal-en-quimica, KAMPION
Que Significa Diagonal En Quimica.
Te enseño como hacer la configuración electrónica de los átomos. La configuracion electronica nos sirve para conocer el acomodo de los electrones en un átomo. Para ello usaremos el diagrama de Moeller (que sigue las reglas de las diagonales), los números cuánticos (nivel, subnivel, orbital y spin), el principio de edificación y la regla de las diagonales. También para hacer más rápido todo, usaremos un método abreviado usando kernel, donde se emplea al gas noble inmediato anterior. Al final te muestro una tabla donde vemos configuraciones anómalas que no siguen las reglas o principios.
La configuración electrónica de un elemento químico nos ayuda a comprender de una mejor manera cómo se encuentran distribuidos los electrones dentro del átomo. Sabiendo la configuración electrónica podemos encontrar a un elemento químico dentro de la tabla periódica, ya que esta está basada en la configuración electrónica de los elementos.
Cada electrón puede ser identificado específicamente gracias a sus cuatro números cuánticos, los cuales son:
° Número Cuántico principal (n): Corresponde al nivel energético en donde se encuentra el electrón. Va desde 1 hacia arriba (1, 2, 3…)
° Número Cuántico secundario o azimutal (l): Corresponde al orbital en donde se encuentra el electrón. Se representa por s (0), p (1), d (2) y f (3).
° Número Cuántico Magnético (m): Indica la orientación del orbital donde se encuentra el electrón. Va desde -l hasta l (incluyendo el 0).
° Número Cuántico de Spin o Giro (s): Este número cuántico se define tradicionalmente como el giro que posee el electrón. Dos electrones con el mismo giro no pueden tener un mismo m (solo se permiten dos electrones por m y deben tener spines (giros) opuestos). Se identifican tradicionalmente como -1/2 y +1/2 o -1 y +1, en esta página web se utilizará la primera identificación (-1/2 y +1/2).
✨Videos sugeridos✨
🔷 Configuración electrónica del CALCIO:
youtu.be/YxzrgGfNnDI
🔷 Diagrama de orbitales:
youtube.com/watch?v=9i9UEMiaxRk
🔷 Estructuras de Lewis:
youtube.com/watch?v=US4CKeK4Q54
⏰ Contenido:
0:00 Introducción: Estructura Electrónica
1:13 Principio de edificación y Regla de las diagonales
2:08 Ejercicio 1: Azufre
3:35 Abreviación con kernel
4:00 Ejercicio 1 con kernel: Azufre
4:24 Ejercicio 2: Potasio
4:54 Ejercicio 2 con kernel: Potasio
5:08 Configuraciones Anómalas
#Cheemistry
ejercicios de configuracion electronica, configuracion electronica ejercicios resueltos, configuracion electronica ejercicios, ejemplos de configuracion electronica, regla de las diagonales, configuracion electronica ejemplos, subniveles de energia, configuración electrónica, configuracion electronica de los elementos, configuracion electronica, distribucion electronica, numeros cuánticos, configuración electrónica y números cuánticos, numeros cuanticos paso a paso, diagrama de moeller, diagrama de moeller 3 eso, diagrama de moeller para que sirve, diagrama de moeller ejercicios, orbitales, numeros cuanticos, numeros cuanticos y configuracion electronica, numeros cuanticos ejercicios, números cuánticos, diagrama de orbitales, configuración electronica con diagrama de orbitales, configuracion electronica del carbono, configuracion electronica del potasio, configuracion electronica del azufre, configuracion electronica del litio, configuracion electronica del nitrogeno, configuracion electronica del sodio, configuracion electronica del magnesio, configuracion electronica del calcio, configuracion electronica del oxigeno, configuracion electronica del fluor, configuracion electronica del aluminio, configuracion electronica de la plata, configuracion electronica del oro, configuracion electronica del cloro, configuracion electronica del bromo, configuracion electronica del estaño, configuracion electronica del francio, configuracion electronica del manganeso, configuracion electronica usando kernel, abreviacion con kernel, configuracion electronica abreviada, distribucion de electrones, configuracion electrónica desarrollada y condensada configuracion electronica desarrollada configuración electronica condensada
QUIMICA EPJA: REGLA DE LAS DIAGONALES Y CONFIGURACION ELECTRONICA
📒 Configuración Electrónica. Regla de las diagonales. Kernel

Source: Youtube.com
💫Configuración Electrónica✔️ [ FÁCIL Y RÁPIDO ] | QUÍMICA |
![💫Configuración Electrónica✔️ [ FÁCIL Y RÁPIDO ] | QUÍMICA |](https://img.youtube.com/vi/PFgurjlMThg/maxresdefault.jpg)
Source: Youtube.com