En química, un electrólito es una sustancia que, cuando se disuelve en agua, produce iones. Los iones son átomos o grupos de átomos con una carga eléctrica neta. Los electrolitos pueden ser fuertes o débiles.
Electrolitos fuertes
Un electrólito fuerte es una sustancia que, cuando se disuelve en agua, se disocia completamente en iones. Esto significa que todos los átomos o grupos de átomos de la sustancia se convierten en iones. Los electrolitos fuertes son buenos conductores de electricidad.
Algunos ejemplos de electrolitos fuertes incluyen:
- Ácidos fuertes: HCl, HNO3, H2SO4
- Bases fuertes: NaOH, KOH, Ca(OH)2
- Sales fuertes: NaCl, KCl, CaCl2
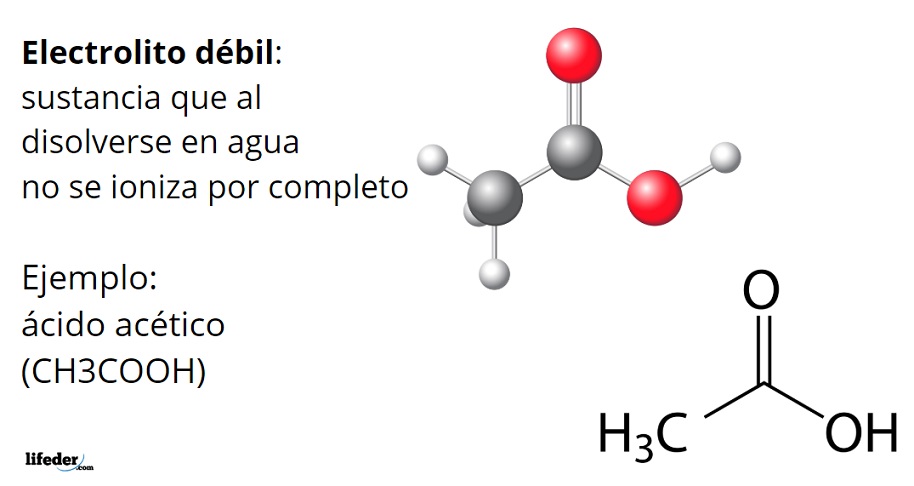
Electrolitos débiles
Un electrólito débil es una sustancia que, cuando se disuelve en agua, solo se disocia parcialmente en iones. Esto significa que solo una parte de los átomos o grupos de átomos de la sustancia se convierten en iones. Los electrolitos débiles son malos conductores de electricidad.
Algunos ejemplos de electrolitos débiles incluyen:
- Ácidos débiles: HF, H2CO3, CH3COOH
- Bases débiles: NH3, CH3NH2, H2SO3
- Sales débiles: NH4Cl, CH3COONa, C6H5COONa
Definición
Un electrólito débil se puede definir como una sustancia que, cuando se disuelve en agua, produce una concentración relativamente baja de iones. La concentración de iones en una solución de electrólito débil se puede medir mediante una propiedad como la conductividad eléctrica.
Factores que afectan la fuerza de un electrólito
La fuerza de un electrólito está determinada por varios factores, incluyendo:
- La naturaleza de la sustancia: algunos tipos de sustancias, como los ácidos y las bases, son más propensos a disociarse en iones que otros.
- La estructura de la sustancia: la estructura de una sustancia puede influir en su capacidad para disociarse en iones.
- La temperatura: la temperatura puede afectar la fuerza de un electrólito. En general, los electrolitos se disocian más fácilmente a temperaturas más altas.
Importancia de los electrolitos débiles
Los electrolitos débiles son importantes en muchas aplicaciones, incluyendo:
- La medicina: los electrolitos débiles se usan en muchos medicamentos, como los antibióticos y los analgésicos.
- La industria: los electrolitos débiles se usan en muchos procesos industriales, como la fabricación de productos químicos y la producción de energía.
- El medio ambiente: los electrolitos débiles se encuentran en muchos entornos naturales, como el agua de mar y el suelo.
Conclusiones
Los electrolitos débiles son sustancias que, cuando se disuelven en agua, solo se disocian parcialmente en iones. La fuerza de un electrólito débil depende de varios factores, incluyendo la naturaleza de la sustancia, su estructura y la temperatura. Los electrolitos débiles son importantes en muchas aplicaciones, incluyendo la medicina, la industria y el medio ambiente.
-
electrolito débil
-
electrólito
-
ion
-
fuerza del electrólito
-
electrólito fuerte
-
electrólito débil
-
ácidos débiles
-
bases débiles
-
sales débiles
-
conductividad eléctrica
-
naturaleza de la sustancia
-
estructura de la sustancia
-
temperatura
-
medicina
-
industria
-
medio ambiente
-
un electrólito débil es una sustancia que, cuando se disuelve en agua, produce una concentración relativamente baja de iones
-
la fuerza de un electrólito está determinada por varios factores, incluyendo la naturaleza de la sustancia, su estructura y la temperatura
-
los electrolitos débiles son importantes en muchas aplicaciones, incluyendo la medicina, la industria y el medio ambiente
WebDefinir y dar ejemplos de electrolitos. Distinguir entre los cambios físicos y químicos que acompañan a la disolución de los electrolitos iónicos y covalentes. Relacionar la fuerza. WebExisten dos grupos de electrolitos: electrolitos fuertes y electrolitos débiles. Los primeros se ionizan completamente, es decir, al 100%. Los segundos se ionizan. Webelectrolito fuerte sustancia que se disocia o ioniza completamente cuando se disuelve en agua electrolito débil sustancia que se ioniza solo parcialmente cuando se. WebEjemplo de electrolito débil. Como se muestra, el cloruro de mercurio (II) (fórmula molecular: HgCl 2 ) se vierte en una solución a base de agua. Cuando el HgCl.
Electrolitos débiles: concepto, características, ejemplos

Source: Lifeder
Cuál es la diferencia entre electrolito fuerte y débil ? Menciona un ejemplo de cada uno en su – Brainly.lat

Source: Brainly
Que Es Un Electrolito Debil Ejemplos, Electrolitos fuertes y débiles | Química | Equilibrio Iónico | V1 | Egg Educación, 4.05 MB, 02:57, 75,321, Egg Live, 2018-09-28T16:47:41.000000Z, 1, Electrolitos débiles: concepto, características, ejemplos, Lifeder, 486 x 914, jpg, , 2, que-es-un-electrolito-debil-ejemplos, KAMPION
Que Es Un Electrolito Debil Ejemplos. WebUn electrolito débil es una solución en la que solo una pequeña fracción del soluto disuelto existe como iones. La ecuación que muestra la ionización de un.
Electrolitos débiles: concepto, características, ejemplos
Que Es Un Electrolito Debil Ejemplos, Webelectrolito fuerte sustancia que se disocia o ioniza completamente cuando se disuelve en agua electrolito débil sustancia que se ioniza solo parcialmente cuando se. WebEjemplo de electrolito débil. Como se muestra, el cloruro de mercurio (II) (fórmula molecular: HgCl 2 ) se vierte en una solución a base de agua. Cuando el HgCl.
Electrolitos fuertes y débiles | Química | Equilibrio Iónico | V1 | Egg Educación

Source: Youtube.com