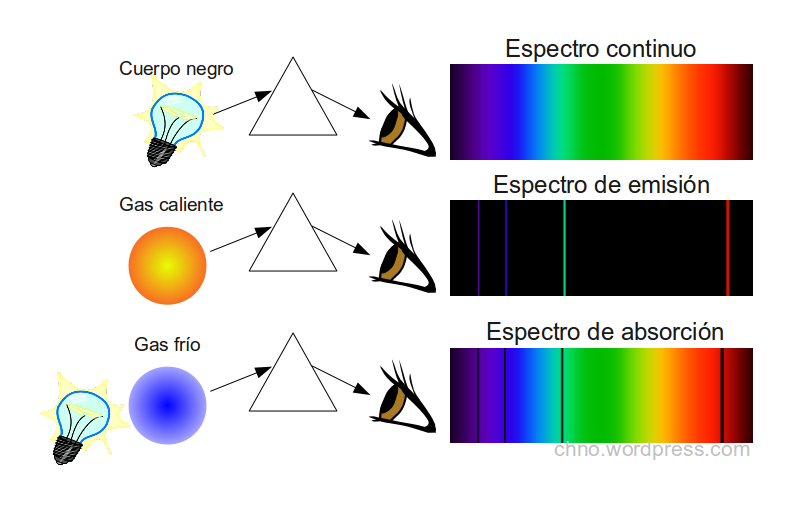
Los espectros de emisión son una representación gráfica de la distribución de la intensidad de la radiación electromagnética emitida por una sustancia, en función de la longitud de onda o la frecuencia de dicha radiación. Los espectros de emisión son producidos por los átomos o moléculas de una sustancia cuando se excitan, es decir, cuando se les proporciona energía adicional.
Los espectros de emisión son una herramienta importante en la química, la física y otras ciencias. Se utilizan para identificar elementos y compuestos químicos, para estudiar la estructura y las propiedades de los átomos y moléculas, y para comprender los procesos químicos.
Tipos de espectros de emisión
Hay dos tipos principales de espectros de emisión:
- Espectros de emisión de líneas: Estos espectros se caracterizan por líneas estrechas y bien definidas. Se producen cuando los átomos o moléculas se excitan a estados energéticos discretos.
- Espectros de emisión de banda: Estos espectros se caracterizan por bandas anchas y difusas. Se producen cuando los átomos o moléculas se excitan a estados energéticos continuos.
Espectros de emisión de líneas
Los espectros de emisión de líneas son los más comunes. Se producen cuando los átomos o moléculas se excitan a estados energéticos discretos, es decir, a estados con energías específicas. La energía necesaria para excitar un átomo o molécula a un estado determinado está determinada por la diferencia de energía entre los dos estados.
Cuando un átomo o molécula excitado vuelve a su estado fundamental, emite un fotón con una energía igual a la diferencia de energía entre los dos estados. La longitud de onda del fotón emitido está determinada por la ecuación de Planck:
λ = hc / E donde:
- λ es la longitud de onda del fotón
- h es la constante de Planck
- c es la velocidad de la luz
- E es la energía del fotón
La ecuación de Planck muestra que la longitud de onda de un fotón emitido es inversamente proporcional a su energía. Por lo tanto, los espectros de emisión de líneas consisten en líneas estrechas y bien definidas, cada una de las cuales corresponde a un fotón con una energía específica.
Espectros de emisión de banda
Los espectros de emisión de banda se producen cuando los átomos o moléculas se excitan a estados energéticos continuos, es decir, a estados con energías que pueden variar dentro de un rango. La energía necesaria para excitar un átomo o molécula a un estado determinado en un rango continuo está determinada por la energía media del rango.
Cuando un átomo o molécula excitado vuelve a su estado fundamental, emite un fotón con una energía que puede variar dentro del rango. La longitud de onda del fotón emitido está determinada por la ecuación de Planck, pero la longitud de onda específica del fotón no se puede predecir con precisión.
Los espectros de emisión de banda se caracterizan por bandas anchas y difusas. La anchura de la banda depende del ancho del rango de energía a partir del cual se excitan los átomos o moléculas.
Aplicaciones de los espectros de emisión
Los espectros de emisión tienen una amplia gama de aplicaciones en la química, la física y otras ciencias. Se utilizan para:
- Identificar elementos y compuestos químicos: Los espectros de emisión son una forma rápida y precisa de identificar elementos y compuestos químicos. Cada elemento y compuesto tiene un espectro de emisión único, que se puede utilizar para identificarlo.
- Estudiar la estructura y las propiedades de los átomos y moléculas: Los espectros de emisión pueden utilizarse para estudiar la estructura y las propiedades de los átomos y moléculas. Por ejemplo, el espectro de emisión de hidrógeno se utilizó para desarrollar el modelo atómico de Bohr.
- Comprender los procesos químicos: Los espectros de emisión pueden utilizarse para comprender los procesos químicos. Por ejemplo, los espectros de emisión se utilizan para estudiar las reacciones químicas y los mecanismos de reacción.
Conclusiones
Los espectros de emisión son una herramienta importante en la química, la física y otras ciencias. Se utilizan para identificar elementos y compuestos químicos, para estudiar la estructura y las propiedades de los átomos y moléculas, y para comprender los procesos químicos.
- espectros de emisión
- espectros de emisión de líneas
- espectros de emisión de banda
- longitud de onda
- frecuencia
- energía
- átomos
- moléculas
- elementos
- compuestos
- estructura
- propiedades
- procesos químicos
WebEl espectro de emisión de un elemento químico o compuesto químico es el espectro de frecuencias de radiación electromagnética emitida debido a un átomo o molécula que. WebUn espectro de emisión es la radiación electromagnética (EMR), como la luz visible, que emite una sustancia. Cada elemento emite una huella de luz única, por lo que analizar. WebUn espectro de emisión atómica es el patrón de líneas que se forman cuando la luz pasa a través de un prisma para separarlo en las diferentes frecuencias de.
Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales

Source: Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales
Espectro de emisión | PDF

Source: SlideShare
Que Es Espectros De Emisión, Que son los Espectros de emision y de absorcion, 5.47 MB, 03:59, 222,298, Quimica IES MIGUEL CATALAN de Coslada, 2018-10-07T20:41:10.000000Z, 1, Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales, Teoría Cuántica y Estructura Atómica: 1.1.3 Espectros de emisión y series espectrales, 529 x 794, jpg, , 2, que-es-espectros-de-emision, KAMPION
Que Es Espectros De Emisión. WebLos espectros de emisión de líneas están formados, como su nombre indica, por líneas luminosas que coinciden con una determinada longitud de onda. Las luces. WebSi hacemos pasar la luz blanca por una sustancia antes de atravesar el prisma sólo pasarán aquellas longitudes de onda que no hayan sido absorbidas por dicha sustancia y.
Explicación de los espectros de emisión y absorción
