
En física y química, un espectro atómico es un conjunto de radiaciones organizadas por las longitudes de onda desde los rayos gamma hasta las ondas de radio. Los espectros atómicos se producen cuando los átomos de un elemento químico o compuesto químico emiten o absorben radiación electromagnética.
Los espectros atómicos son una herramienta importante en la ciencia porque pueden utilizarse para identificar elementos y compuestos químicos. También pueden utilizarse para estudiar la estructura interna de los átomos y las moléculas.
Tipos de espectros atómicos
Hay dos tipos principales de espectros atómicos:
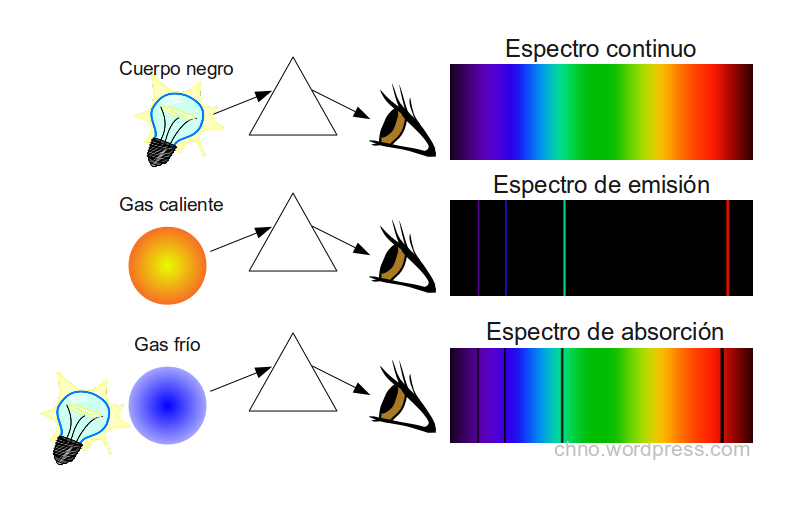
- Espectros de emisión: Los espectros de emisión se producen cuando los átomos de un elemento químico emiten radiación electromagnética al pasar de un estado de alta energía a un estado de menor energía.
- Espectros de absorción: Los espectros de absorción se producen cuando los átomos de un elemento químico absorben radiación electromagnética.
Espectros de emisión
Los espectros de emisión son un conjunto de líneas estrechas de luz de diferentes colores. Cada línea representa una transición específica entre dos estados de energía del átomo.
La frecuencia de la luz emitida está determinada por la diferencia de energía entre los dos estados de energía. La energía de un estado de energía se puede calcular utilizando la ecuación de Rydberg:
E = -13.6 eV / n² donde:
- E es la energía del estado de energía
- n es el número cuántico principal del estado de energía
Por ejemplo, el espectro de emisión del hidrógeno consta de una serie de líneas estrechas de luz que se extienden desde el ultravioleta hasta el infrarrojo. Estas líneas representan las transiciones entre los diferentes estados de energía del átomo de hidrógeno.
Espectros de absorción
Los espectros de absorción son un conjunto de bandas oscuras en un fondo de luz continua. Cada banda oscura representa una longitud de onda de luz que es absorbida por los átomos de un elemento químico.
La frecuencia de la luz absorbida está determinada por la diferencia de energía entre los dos estados de energía del átomo. La energía de un estado de energía se puede calcular utilizando la ecuación de Rydberg.
Los espectros de absorción se utilizan a menudo para identificar elementos químicos en una muestra. Por ejemplo, si se pasa luz blanca a través de una muestra de un elemento químico, las longitudes de onda de luz que son absorbidas por los átomos del elemento aparecerán oscuras en el espectro de absorción.
Aplicaciones de los espectros atómicos
Los espectros atómicos tienen una amplia gama de aplicaciones en la ciencia y la tecnología. Algunas de las aplicaciones más importantes de los espectros atómicos incluyen:
-
Identificación de elementos y compuestos químicos: Los espectros atómicos se utilizan para identificar elementos y compuestos químicos en muestras.
-
Estudio de la estructura interna de los átomos y las moléculas: Los espectros atómicos se utilizan para estudiar la estructura interna de los átomos y las moléculas.
-
Control de calidad: Los espectros atómicos se utilizan para controlar la calidad de los materiales y productos.
-
Medición de la composición de la atmósfera: Los espectros atómicos se utilizan para medir la composición de la atmósfera.
-
espectro atómico
-
espectro de emisión
-
espectro de absorción
-
átomo
-
elemento químico
-
compuesto químico
-
radiación electromagnética
-
longitud de onda
-
frecuencia
-
energía
-
estado de energía
-
número cuántico principal
-
ecuación de Rydberg
-
identificación
-
estructura interna
-
control de calidad
-
composición de la atmósfera
Conclusión
Los espectros atómicos son una herramienta importante en la ciencia y la tecnología. Pueden utilizarse para identificar elementos y compuestos químicos, estudiar la estructura interna de los átomos y las moléculas, y controlar la calidad de los materiales y productos.
WebDebido a que el espectro de un elemento es fácilmente reproducible y se puede medir con tanta precisión, a menudo se usa para determinar longitudes. Por. WebEl espectro atómico es un conjunto de radiaciones organizadas por las longitudes de onda desde los rayos gamma hasta las ondas de radio; y el espectro electromagnético es un. WebPrincipios básicos de la teoría cuántica: hipótesis de De Broglie. Principio de indeterminación de Heisenberg. Función de onda de Schrödinger. Modelo atómico. WebIntroducción a la espectroscopía. Los químicos estudian cómo diferentes formas de radiación electromagnética interactúan con átomos y moléculas. Llamamos a esta.
Espectro atómico | PDF

Source: SlideShare
EL FÍSICO LOCO: Espectros atómicos. Emisión y absorción
Source: EL FÍSICO LOCO: Espectros atómicos. Emisión y absorción
Que Es Un Espectro Atomico, Que son los Espectros de emision y de absorcion, 5.47 MB, 03:59, 222,298, Quimica IES MIGUEL CATALAN de Coslada, 2018-10-07T20:41:10.000000Z, 1, Espectro atómico | PDF, SlideShare, 414 x 320, jpg, , 2, que-es-un-espectro-atomico, KAMPION
Que Es Un Espectro Atomico. WebEl espectro de emisión atómica de un elemento es un conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos de ese elemento. Cada espectro de. WebEl espectro atómico de emisión es el espectro formado por la radiación emitida por los electrones en moléculas o átomos excitados; Un espectro de bandas es la parte de la. WebPara el tungsteno, Z = 74, Z = 74, por lo que la carga efectiva es de 73. Este número puede utilizarse para calcular la diferencia del nivel de energía entre las capas L y K y, por.
Explicación de los espectros de emisión y absorción
Espectro atómico | PDF
Que Es Un Espectro Atomico, WebPrincipios básicos de la teoría cuántica: hipótesis de De Broglie. Principio de indeterminación de Heisenberg. Función de onda de Schrödinger. Modelo atómico. WebIntroducción a la espectroscopía. Los químicos estudian cómo diferentes formas de radiación electromagnética interactúan con átomos y moléculas. Llamamos a esta.
